Ocena snu u dzieci z Mukopolisacharydozą typu III
- Home
- O badaniach
- Ocena snu u dzieci z Mukopolisacharydozą typu III
Głównym objawem Mukopolisacharydozy typu III są zaburzenia snu, obecnie brak jest obiektywnych,wiarygodnych, udokumentowanych badań opisujących ilość oraz jakość snu czy rytm okołodobowy. Badanie aktograficzne zostało przeprowdzone na 8 dzieciach chorych na Mukopolisacharydozę typu III oraz 8 osobowej, dopasowanej wiekowo grupie kontrolnej zdrowych dzieci przez okres 7-10 dni/nocy. Próbki sliny były pobierane 3 razy dziennie w ciągu 2óch dni w celu analizy poziomu endogennej melantoniny. Rodzice pacjentow wypełniali kwestionariusz oraz dziennik dotyczący zaburzeń snu. Badanie aktograficzne wykazało, iż dzieci z MPS mają znacząco wydłużony okres zasypiania oraz śpią znacznie dłużej w ciągu dnia w porównaniu do grupy kontrolnej, czas spania w nocy nie różnił się pomiędzy obiema grupami. W grupie badanej dzieci chorych na MPS III zauważono, iż z wiekiem wydajność snu spadła oraz wydłużył się okres zasypiania. Odpowiedzi na pytania z kwestionariusza pokazały, że pacjenci z MPS III cierpią na znaczące zaburzenia snu we wszystich domenach w porównaniu do grupy kontrolnej. Zgromadzenie melatoniny ukazało, jak wygląda jej przemiana u dzieci z MPS III, co sugeruje, iż leczenie zaburzeń snu powinno polegać na synchronizacji cyklów snu oraz rozbudzenia do bardziej regularnego wzorca. Badania aktograficzne było dobrze tolerowane przez dzieci a urządzenie pomiarowe wykorzystane w tej metodzie może być zalecane do mierzenia postępów leczenia podczas badania oraz praktyce klinicznej.
Mukopolisacharydoza typu III (MPS III/Zespół Sanfilippo) jest dziedzicznym, metabolicznym schorzeniem charakteryzującym się brakiem lizosomalnych enzymów potrzebych do rozkładu glukosoaminoglikanów (GAGs). Gromadzenie glukozoaminoglikanów prowadzi do postępującej dysfunkcji: komórek, tkanek i organów. Przypadki choroby różnią się pomiędzy krajami, w Wielkiej Brytanii częstotliwość występowania wynosi 1.21 na 100000 dzieci. Występują 3 fazy choroby:
Pierwsza faza (występuje u dzieci pomiędzy 1-4 rokiem życia) charakteryzuje się opóźnieniem w rozwoju,
druga faza (występuje pomiędzy 4 -10 rokiem życia) charakteryzuje się zaburzeniami w zachowaniu, zaburzeniami snu, agresywnym oraz destrukcyjnym zachowaniem, zwiększoną aktywnością oraz trudnościami w koncentracji
trzecia faza (występuje w wieku powyżej 10 roku życia) charakteryzuje się postępującym traceniem umiejętności (głównie językowych), atakami padaczki, problemami z poruszaniem się oraz połykaniem.
Istnieją cztery podtypy Mukopolisacharydozy typu III oznaczone jako A, B, C, D które różnią się ilością enzymu rozkładającego glukosoaminoglikany, typy A i B występują najczęsciej podczas gdy D najrzadziej. Jest jedynie niewielka kliniczna różnica pomiędzy podtypami choroby – podtyp A może charakteryzować się ostrym przebiegiem a C łagodniejszym.
Najczęstszym objawem Mukopolisacharydozy typu III są zaburzenia snu: szczególnie problemu z zasypianiem, chodzenie w nocy oraz wczesnym rankiem.
Mimo zastosowania dwóch podejść farmakologicznego oraz behawioralnego większość sposób lecznia okazała się nieskuteczna chociaż zaobserwowano nieznaczną poprawę stanu zdrowia pacjentów.
Obecnie dostępne są jedynie nieliczne informacje dotyczące zaburzeń snu u chorych na Mukopolisacharydozę typu III. Cztery przeprowadzone badania ankietowe przeznaczone dla rodziców pokazały, iż 67-91,5% pacjentów cierpi na zaburzenia snu, w tym trudności z zasypianiem, chodzenie nocne, całonocne rozbudzenie. Pacjenci również płacza, chodzą po domu w nocy, wchodzą do łóżka rodziców, śmieją się oraz śpiewają w nocy. U dzieci z podtypem B znacznie częściej występuje poranne oraz nocne chodzenie niż u dzieci z podtypem A. Średni wiek, w którym odnotowano pierwsze problemy związane z zasypianiem to 3.8 lat. Opiekunowie zaobserwowali powiązanie pomiędzy zaburzeniami snu w nocy oraz w dzień i zachowaniami agresywnymi.
Pomimo, iż żaden ze stosowanych leków nie wykazuje terapeutycznego efektu, zastosowanie melataniny znacząco o 50% poprawiło stan pacjentów w szczególności wpływając na ich zachowanie.
Lekarze odnotowali, iż u 80-95% chorych na MPS cierpiących na poważne zaburzenia snu, zachowanie wciągu dnia było znaczne gorsze, aczkolwiek niektórzy zaobserwowali poprawę.
Badanie polisomograficzne(PSG) oraz aktograficzne mogą służyć do obiektywnej analizy snu.
Mariotti stosując medtody polisomograficzne zbadał 6 pacjentów z Mukopolisacharydozą typu III A w wieku pomiędzy 7 a 20 rokiem życia (średnia 14.1 lat). Pacjenci z MPS III w porównaniu do grupy kontrolnej odznaczali się krótszym czasem snu w nocy (240.5 min vs. 458.3), krótszą fazą REM (8.03% vs. 21.53%) oraz mniejszą głębokością snu (10.18% vs. 24.63%) ale dłuższym czasem spania w ciągu dnia (88.8% vs.24.8%). Dwóch najmłodszych pacjentów (w wieku 7 i 9 lat) spało głównie w nocy ale cierpieli na nocne chodzenie, podczas gdy dzieci powyżej 12 roku życia spały fragmentarycznie, z różną długością snu w czasie dnia oraz w nocy. Badanie aktograficzne wykazało znaczące ruchy ciała pomiędzy okresami bezsenności oraz czasem snu. Badania aktograficzne jest bardziej dokładne niż dzienniki snu, koreluje z PSG, jest tańsze, mniej inwazyjne niż PSG i może być używane do zgromadzenia prawdziwych informacji dotyczących snu w długim okresie.
Biorąc pod uwagę występowanie nieregularnych zaburzeń snu, pojawiających się i zanikających w czasie dnia i nocy u chorych na MPS III nasuwa się przypuszczenie, iż są one związane z nieprawidłowościami w cyklicznym uwalnianiu melatoniny. Guerrero, Pozo, Diaz-Rodrguez, Martinez-Cruz i Vela-Campos porównywali 12 pacjentów z MPS III oraz próbę kontrolną składającą się z 9ciu pacjentów w wieku od 6 do 14lat przez okres 24 godzin. Chorzy na MPS III w porównaniu do próby kontrolnej mieli zmniejszony poziom melatoniny w ciągu nocy oraz zwiększony w ciągu dnia. W badaniu na myszach, myszy z MPS III B miały zwiększony poziom aktywności podczas faz odpoczynku, krótszą fazę odpoczynku oraz mniejsze wahania cyklu w porównaniu do dopasowanej wiekowo grupy kontrolnej myszy. Te odkrycia potwierdzają, iż MPS jest związane z dyskuncją systemu cyklicznego uwalniania melatoniny co może okazać się istotnym biomarkerem oraz znaczącącą kliniczną miarą.
Głównym celem zaprezentowanego badania było zebranie objektywnych, przekonywających informacji o śnie oraz cyklinicznym uwalnianiu melatoniny u dzieci chorych na MPS III.
Hipoteza badania: Pacjenci z MPS III mają: znaczące problemy z zasypianiem, skrócony czas spania w nocy, gorszą jakość snu, wydłużony czas spania w nocy oraz odmienny system cyklicznego uwalniania melatoniny. Drugim celem było potwierdzenie stosowania badania aktograficznego jako skutecznej i dokładnej metody badania snu. Do tej pory nie wykorzystano jeszcze badania aktograficznego oraz analizy poziomu melatoniny w ślinie jak również połączonego badania wykorzystującego obie wymienione metody.
UCZESTNICY
W badaniu wzieło udział ośmioro dzieci chorych na MPS III (5 chłopców, 3 dziewczynki, średnia wieku 9 lat i 3 miesiące, SD 4.86, przedział wieku: 2-15 lat). Pacjenci zostali zarejestrowani przez swoich lekarzy w Willink Biochemical Genetic Unit lub Brytyjskie Stowarzyszenie Pacjentów Chorych na MPS. Dzieci zostały wybrane do badania na podstawie diagnozy, mniej znaczące były występowanie zaburzeń snu. Diagnoza była potwierdzona poprzez analize moczu oraz charakterystycznych enzymów. Pacjencji,którzy: brali udział w badaniu z wykorzystaniem leku, mieli przeszczep szpiku kostnego, ciężką chorobę mającą wpływ na inny organ lub pacjenci w końcowym, ciężkim stadium choroby, bliscy śmierci (zgodnie z zaleceniem lekarza) zostali wykluczeni z badnia. Demograficzne szczegóły zostały przedstawione w tabeli nr 1.

Dwóch pacjentów z MPS III miało padaczke a rodzice tych dzieci zauważyli korelację pomiędzy brakiem snu w nocy a napadami drgawek. Młodsi pacjenci nie zażywali żadnych leków podczas gdy starszym pacjentom przepisano leki nasenne (np.melatoninę, wodzian chloralu, zopiclon), na padaczkę (walproinian sodu) lub zwalczające inne objawy choroby takie jak ból. Tylko jeden z pacjentów zażywał egzogenną melatoninę mającą wpływ na rytm okołodobowy. Leczenia nią zostało jednak przerwane 2 tygodnie przed rozpoczęciem zbierania danych by próbki śliny prezentowały rzeczywisty, fizjologiczny poziom melatoniny oraz naturalny rytm okołodobowy nie zamaskowany przez ciągłe stosowanie endogennej melatoniny. Inne leki nie zostały zamienione. Dzieci wybrane do grupy kontrolnej dopasowanej wiekowo (4 chłopców, 4 dziewczynki średnia wieku 8 lat 7 miesięcy, SD 4.85 przedział wieku 3-15 lat) nie wykazywały zaburzeń rozwoju, chorób psychicznych oraz neurologicznych, urazów mózgu, zaburzeń snu oraz żadne z nich nie zażywało leków.
MATERIAŁY I PROCEDURA
Listy opisujące projekt zostały rozesłane do rodzin wszystkich dzieci cierpiących na MPS III znajdujących się pod opieką szpitala Wilink Unit lub znanych Brytyjskiemu Stowarzyszeniu Pacjentów Chorych na MPS (MPS Society UK). Dzieci pracowników Uniwersytetu w Manchesterze lub lokalnego odziału NHS (Narodowa Służba Zdrowia) utworzyły grupę kontrolną. Karty informacyjne dla uczestników zostały dostarczone rodzinom, które wykazały zainteresowanie udziałem w badaniu. Badacze spotkali się z każdą rodziną w celu zebrania danych demograficznych dotyczących poszczególnych dzieci. Rodzice uzupełniali Skalę Oceny Dziecięcych Zwyczajów Sennych (E. Saphiro, personal communication, 6. września, 2010), listę kontrolną utworzoną w oparciu o Kwestionariusza Dziecięcych Zwyczajów Sennych w celu ustalenia problemów związanych ze snem występujących u pacjentów z MPS III. Lista kontrolna wymagała od rodziców wskazania częstotliwości występowania poszczególnych zachowań sennych w przeciągu typowego tygodnia. Zachowania były przyporządkowywane zgodnie z trzystopniową skalą: „zazwyczaj” dla zachowań występujących od pięciu do siedmiu razy w tygodniu, „czasami” dla występujących od dwóch do czterech razy w tygodniu, oraz „sporadycznie/nigdy” dla zachowań pojawiających się maksymalnie raz w ciągu tygodnia.
Każde z dzieci nosiło na nadgarstku niedominującej ręki aktograf (Respironics Actiwatch 2/Cambridge Neurotechnology AW4) przez okres od siedmiu do dziesięciu dni i nocy, wykonując w tym czasie wszystkie codzienne czynności. Zastosowany został 15-sekundowy interwał próbkowania. Poprzednie badanie wykazało, że w celu uzyskania wystarczającego do badań aktograficznego nagrania snu dziecka potrzebne są dane z co najmniej pięciu nocy, oraz że monitorowanie aktograficzne powinno trwać co najmniej siedem nocy w celu kompensacji takich czynników jak choroby, problemy techniczne oraz niestosowanie się do zasad badania[23]. Nagrywanie przez co najmniej tydzień oznaczało, że dane mogą być gromadzone w trakcie dni szkolnych oraz w weekendy, co jednocześnie narażało na potencjalną utratę danych. Do parametrów snu poddawanych badaniu należały: długość zasypiania (sleep onset latency) (czas pomiędzy „zgaszeniem światła” a zaśnięciem), całkowity czas trwania snu nocnego, wydajność snu (procent czasu trwania snu pomiędzy „wyłączeniem światła” a „wstaniem z łóżka”), przebudzenie po zaśnięciu (WASO, całkowita ilość minut w stanie przebudzenia pomiędzy zaśnięciem a ostatecznym obudzenia się), czas spędzony w łóżku (minuty) oraz całkowity czas trwania snu w ciągu dnia (całkowita ilość minut przespanych pomiędzy porannym przebudzeniem a porą spania). W celu uniknięcia mylących skutków dużych, sezonowych zmian rytmów okołodobowych, dane zebrano w okresie sześciu miesięcy oraz w roku szkolnym, w celu zapewnienia zgodności pomiędzy badanymi osobami. Opiekunowie każdego dnia odnotowywali w dzienniku porę spania oraz wstawania ich dziecka, czas gaszenia oraz zapalania światła oraz wszystkie wydarzenia mające miejsce w nocy.
Aby umożliwić badanie wewnętrznych poziomów melatoniny, rodzice pobierali próbki śliny od swoich dzieci w trzech przedziałach czasowych (pomiędzy godzinami 6-8, 10-12, 22-24) w dniu rozpoczęcia nagrań aktograficznych. Próbki zbierane były przy zastosowaniu zasysającej cewki (de Lee suction catheter; Argyle, Sherwood Medical, Tullamore, Ireland) i do czasu analizy pozostawały zamrożone w temperaturze −20°C. Nocny pobór próbki przeprowadzany był w przyćmionym świetle. Próbki zbierano zgodnie z procedurami wyznaczonymi przez producenta zestawów testów immunoenzymatycznych (ELISA) (www.IBL-International.com) w celu umożliwienia testu ELISA z zastosowaniem melatoniny nieekstrahowanej ze śliny (IBL, Hamburg, Germany). Wstępna analiza wykazała, że dane były rzetelne, gdyż odchylenie standardowe od średniej wynosiło mniej niż 20%. Dane dotyczące jednej odstającej próbki zostały usunięte. Próbki, których brakowało lub były niekompletne zostały wyłączone z badania, jednak aż 88,5% próbek śliny nadawało się do użycia.
ANALIZA
Dane aktograficzne zostały przetransferowane do programu Actiware wersja 5.5 (Respironics). Interwały spoczynku zostały wyznaczone w oparciu o informacje zawarte w dziennikach oraz o przegląd aktogramów (gdzie aktywność oraz intensywność światła zmniejszały się). Dane pochodzące z aktografii oraz kwestionariuszy zostały wprowadzone do programu SPSS wersja 19, w celu analizy. Dane aktograficzne kilku uczestników pochodzące z pojedynczych nocy musiały zostać wykluczone z dalszej analizy ze względu na chorobę lub niezastosowanie się do warunków badania, jednak minimum danych pochodzących z siedmiu nocy zostało pozyskane przez wszystkie badane osoby. Dla wszystkich testów statystycznych zastosowano współczynnik alfa w wysokości 0.05.
WYNIKI
SKALA OCENY DZIECIĘCYCH ZACHOWAŃ SENNYCH
Średni wiek rozpoczęcia problemów związanych ze snem dla pacjentów z MPS III to 2 lata (SD 2.33, range birth-7). W skład problemów związanych ze snem zidentyfikowanych przez rodziców wchodziły trudności z uspokojeniem, budzenie się w nocy, wczesne budzenie poranne, zbyt krótki sen. Większość dzieci (62,5%) podczas prób zaśnięcia potrzebowała rodzica w pokoju. Połowa dzieci zasypiała w niektóre noce w trakcie pierwszych dwudziestu minut, ale 37,5% zasypiało w tym czasie sporadycznie lub nigdy. Większość rodziców uważała, że ich dzieci śpią zbyt krótko przez co najmniej dwie noce w ciągu każdego tygodnia, ale przez pozostałe noce zdawały się przesypiać odpowiednią ilość snu. Większość dzieci budziła się raz (62,5%) lub wielokrotnie (87,5%) w ciągu nocy. Większość dzieci (75%) wykazywała zaburzenia zachowania w ciągu nocy (np. krzyczenie, śpiewanie, śmiech), a 25% dzieci wykazywało zachowania niebezpieczne (np. wybieganie na zewnątrz, zabawa urządzeniami). Wszystkie dzieci w ciągu nocy były niespokojne i ruchliwe a 50% z nich spało w ciągu dnia.
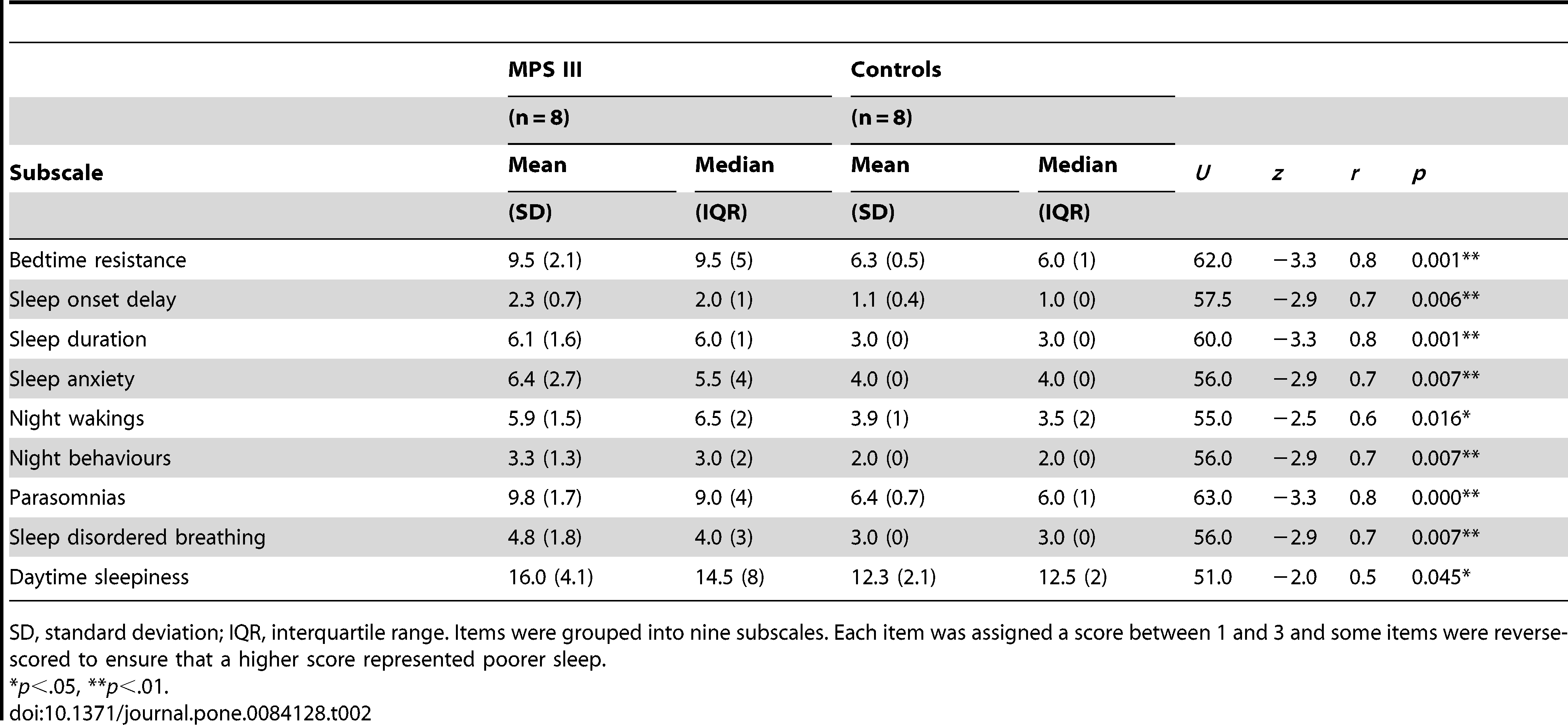
Testy Manna-Whitneya-Wilcoxona wykazały, że grupa z MPS III miała istotnie bardziej zaburzony sen we wszystkich obszarach badanych za pomocą Skali Dziecięcych Zachowań Sennych. Wyniki zostały zaprezentowane w Tabeli 2.
AKTOGRAFIA
Jak zostało zasugerowane przez Acebo i współpracowników [23], dane aktograficzne dla każdego z uczestników zostały uśrednione przed analizą w okresie nagrywania. Dane aktograficzne dla każdego z pacjentów cierpiących na MPS III ukazane zostały w Tabeli 3.
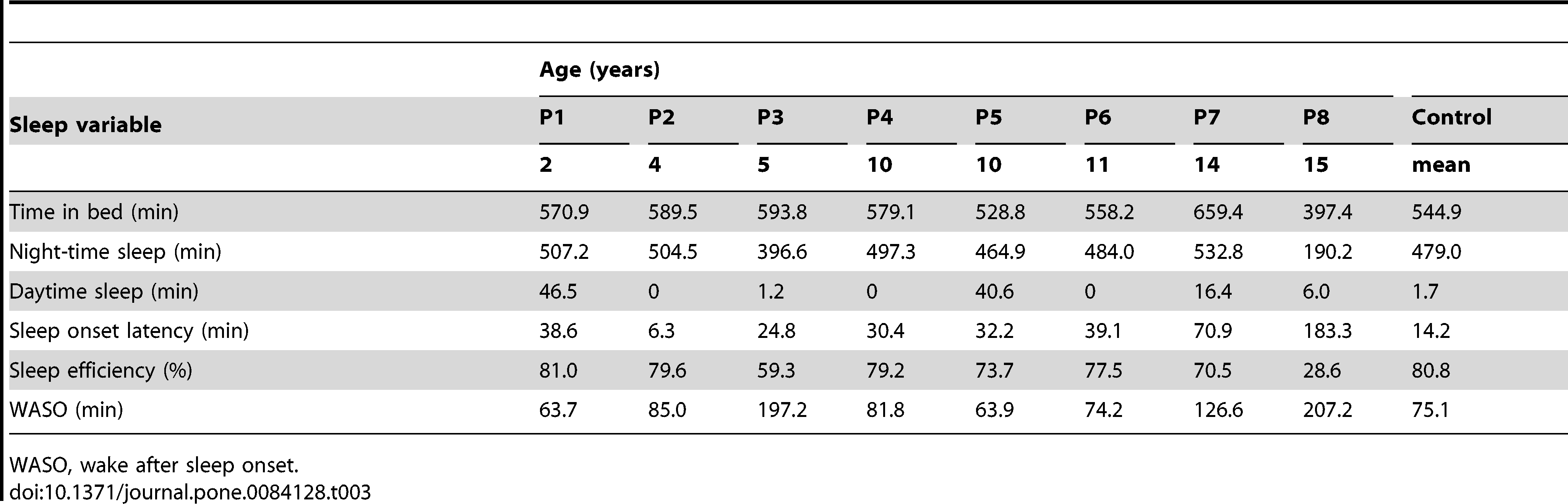
U niektórych pacjentów czas snu nocnego był zmniejszony, szczególnie u P8, który sypiał średnio 190 minut w ciągu nocy, jednakże większość dzieci przesypiała nocą odpowiednie ilości snu. Pięcioro z ośmiorga dzieci niekiedy spało w ciągu dnia w okresie trwania monitoringu aktograficznego, ale większość dzieci nie drzemała codziennie. Opóźnienie zaśnięcia było istotnie wysokie u większości dzieci. Jedno z młodszych dzieci zasypiało bardzo szybko, w ciągu około 6 minut, jednak dwoje najstarszych dzieci miało wyraźnie długi czas zasypiania wynoszący odpowiednio około 1 godziny 10 minut oraz 3 godzin. Pozostałym pięciorgu dzieciom zaśniecie zajmowało od 25 do 40 minut. U niektórych dzieci zmniejszona była wydajność snu, z najstarszym dzieckiem śpiącym przez jedynie 28% czasu spędzonego w łóżku oraz pięciolatkiem śpiącym przez zaledwie 59% czasu spędzonego w łóżku. WASO był podwyższony u wszystkich dzieci, szczególnie u dwóch najstarszych badanych, i rozciągał się pomiędzy uczestnikami od 64 minut do 207 minut w ciągu nocy.
Dane aktograficzne pozyskane z poszczególnych grup analizowane były przy zastosowaniu testów Manna-Whitneya-Wilcoxona a ich wyniki zostały przedstawione w Tabeli 4.
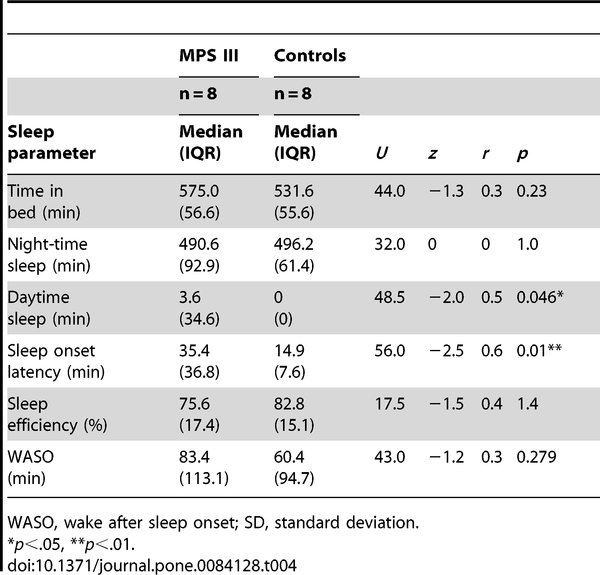
Opóźnienie rozpoczęcia snu było istotnie dłuższe u dzieci z MPS III w porównaniu z grupą kontrolną. Długość trwania snu nocnego oraz czasu spędzonego w łóżku nie różniły się istotnie pomiędzy grupami. Mimo że wydajność snu była niższa u pacjentów z grupy badawczej w porównaniu do kontroli, nie osiągnęła ona istotności statystycznej. Czas trwania snu dziennego był istotnie dłuższy u uczestników z MPS III niż w grupie kontrolnej. Średnie grup przedstawione zostały na Rycienie 1.
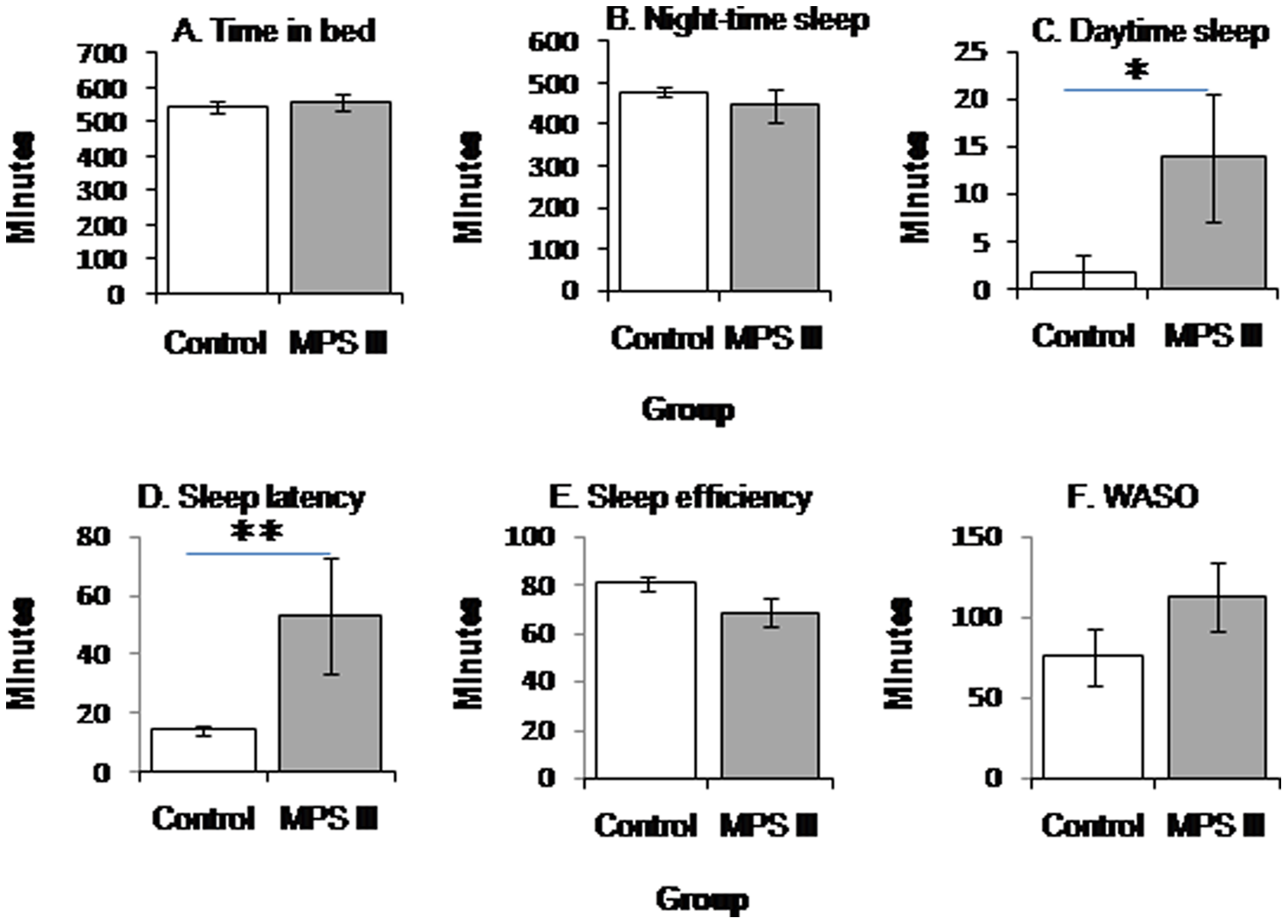
W grupie MPS III, współczynniki korelacji rang Spearmana wykazały pozytywną korelację pomiędzy wiekiem a opóźnieniem rozpoczęcia snu, rs = 0.755, n = 8, p = 0.031, oraz negatywną korelację pomiędzy wiekiem a wydajnością snu, rs = −0.719, n = 8, p = 0.045. Nie wykazano istotnej statystycznie korelacji pomiędzy wiekiem a pozostałymi zmiennymi.
ANALIZA MELATONINY
Poziomy melatoniny pobrane jednego dnia o określonych porach zostały ukazane w Tabeli 5, zaś porównanie grup przedstawia Rycina 2.
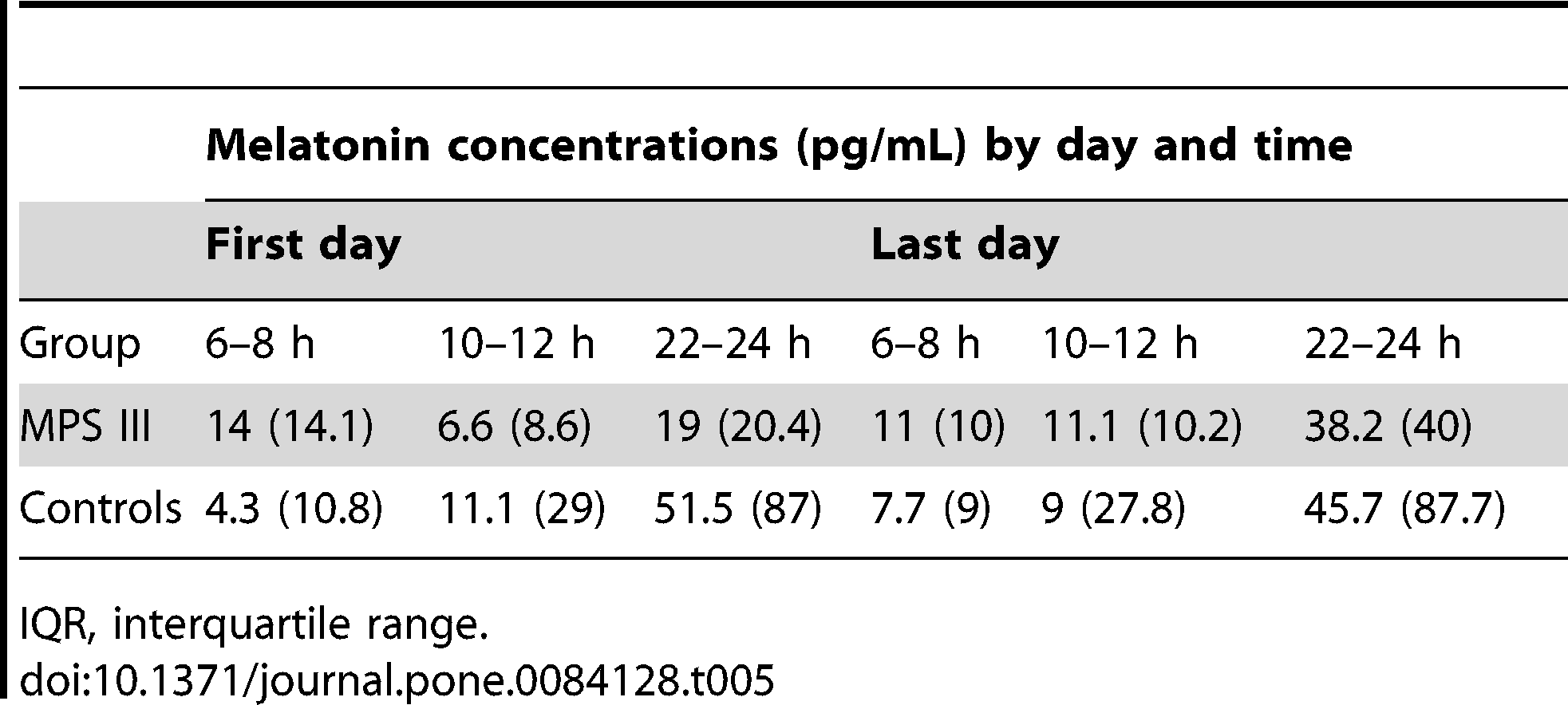
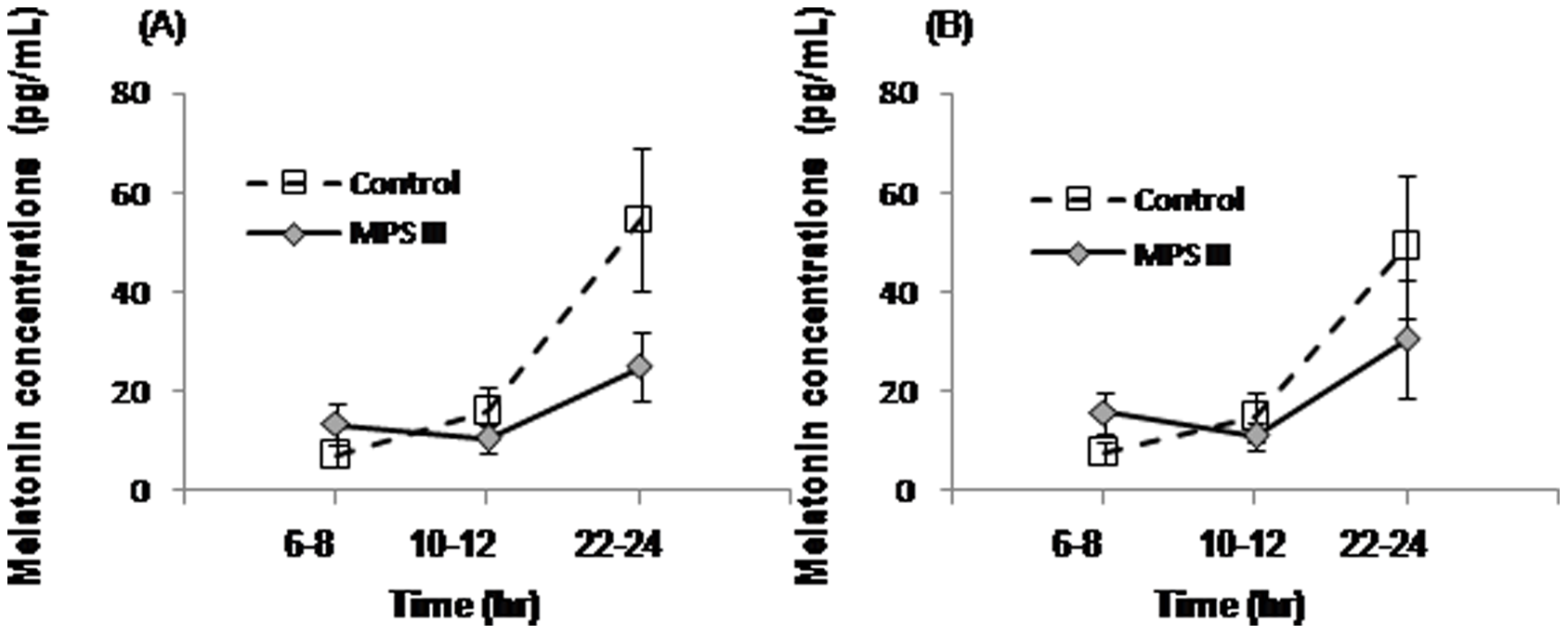
W celu określenia czy stężenia melatoniny miały związek z dniem, w jaki ją pobierano (pierwszy dzień vs. ostatni dzień), przeprowadzono testy Manna-Whitneya-Wilcoxona na danych pochodzących od pacjentów oraz od grupy kontrolnej, które wykazały brak istotnego statystycznie wpływu dnia (p>0.05). Test Friedmana wykazał statystycznie istotną różnicę w stężeniu melatoniny dla grupy kontrolnej w różnych punktach czasowych (Czas 1: 6–8., Czas 2: 10-12, Czas 3: 22–24) pierwszego dnia, χ2(2) = 10.33, p = 0.002, oraz ostatniego dnia, χ2(2) = 9.33, p = 0.006. Wykonane post hoc testy Wilcoxon z korektą Bonferroniego (korekta poziomu istotności 0.016) wykazało istotną różnicę pomiędzy Czasem 2 a Czasem 3 w obydwu dniach (p = 0.016, r = 0.61), ale różnica pomiędzy Czasem 1 a Czasem 3 była ledwo powyżej progu istotności (p = 0.031, r = 0.59). W grupie MPS III nie było zasadniczych różnic pomiędzy punktami czasowymi pierwszego χ2(2) = 0.50, p = 0.931, ani ostatniego χ2(2) = 2.80, p = 0.367 dnia. Wizualny przegląd danych sugerował, że grupa z MPS III miała wyższe stężenia melatoniny w godzinach 6-8 i niższe poziomy w godzinach 22-24, w porównaniu do grupy kontrolnej, jednakże testy Manna-Whitneya-Wilcoxona nie wykazały istotnych różnic pomiędzy grupami.
DYSKUSJA
Dzieciom z MPS III zasypianie zajmowało więcej czasu oraz spały one więcej w ciągu dnia w porównaniu z odpowiadającymi im wiekowo typowo rozwijającymi się dziećmi, co wspierało początkową hipotezę. Występowały tendencje w kierunku zmniejszonej wydajności snu oraz zwiększonej bezsenności nocnej w grupie pacjentów. Trwanie snu nocnego nie było zubożone w grupie pacjentów, co stoi w sprzeczności z hipotezą. Jak przewidziano, odpowiedzi na Dziecięcą Skalę Zachowań Sennych wykazały, że rodzice dzieci z MPS III zgłosili większe zaburzenia snu we wszystkich obszarach w porównaniu z rodzicami typowo rozwijających się dzieci. W grupie pacjentów, wyższy wiek wiązał się z dłuższym opóżnieniem rozpoczęcia snu i mniejszą wydajnością snu. Jak przypuszczano, dzieci z MPS III wykazały zaburzenie cyklu okołodobowego.
Grupie z MPS III zasypianie zajmowało średnio 53 minuty w porównaniu z przewidywanym wynikiem 20-30 minut [24], [25]. Opóźnione rozpoczęcie snu w mukopolisacharydozie typu III sugeruje problemy w inicjowaniu snu, które mogą mieć związek z niskimi poziomami melatoniny nocą. Pacjenci z MPS III przeciętnie spali w ciągu dnia 14 minut, wśród nich pacjenci w późnym stadium choroby spali w ciągu dnia więcej niż pacjenci w środkowej fazie. Wyniki te były w zgodzie z poprzednimi wynikam badań polisomograficznych[12].
Powinno się zwrócić uwagę, że senność w ciągu dnia u dzieci powiązana jest z problemami związanymi z zachowaniem, depresją oraz obniżoną jakością życia [26]. Wraz z wiekiem, dzieciom z MPS III zasypianie zajmowało więcej czasu, zaś ich sen był mniej wydajny. Dzieci zdrowe przesypiają co najmniej 80% czasu spędzonego w łóżku [27], [28], jednak średnia w grupie z MPS III wynosiła 68,7%. Wydajność snu dla niektórych dzieci była niewiele niższa od normy, jedynie dwóch uczestników wykazywało bardzo obniżoną wydajność snu (odpowiednio 59.3% i 28,6%). Łączna ilość czasu gdy dzieci z MPS III były przebudzone w ciągu nocy była bardzo duża, ze średnią prawie około dwóch godzin każdej nocy, co było najbardziej dostrzegalne w przypadku bezsenności dwóch najstarszych dzieci.
W pracy Mariotti’ego i współpracowników [12] sen nocny w mukopolisacharydozie typu III był zredukowany. W bieżącym badaniu uśredniony sen nocny w grupie z MPS III był niższy niż w grupie kontrolnej, jednakowoż nie różnił się on w sposób istotny. Sen niektórych pacjentów różnił się w ciągu różnych nocy, a gdy sen był uśredniony w okresie przeprowadzania badania, dzieci z MPS III zdawały się mieć wystarczającą ilość snu. Wszyscy badani przez Mariotti’ego i współpracowników [12] cierpieli na Mukopolisacharydozę typu III podtyp A, podczas gdy w obecnym badaniu brały udział osoby zarówno z podtypem A jak i B. Mogą być z tym związane niektóre z wykazanych różnic, tak samo jak i z różnicą w wieku badanych występująca pomiędzy obydwoma badaniami.
Wyniki Skali Oceny Dziecięcych Zwyczajów Sennych wykazały, że w porównaniu z typowo rozwijającymi się dziećmi, rodzice dzieci z MPS III postrzegali swoje dzieci jako mające większe problemy z zasypianiem, długością trwania snu, niepokojem podczas snu chodzeniem nocnym, zachowaniami nocnymi, parasomnią, zaburzonym oddychaniem podczas snu oraz sennością w ciągu dnia jak również jako niechętne do pójscia spać. Średni wiek rozpoczęcia problemów związanych ze snem wynosił dwa lata, ale zaburzenia oddychania w czasie snu (chrapanie, prychanie/sapanie oraz bezdech) mogą w niektórych wypadkach występować od urodzenia [29], [30], [6].
W pracy badawczej przeprowadzonej na mysim modelu Mukopolisacharydozy [18] zaprezentowano wyniki porównywalne do bieżącego badania. Myszy z Mukopolisacharydozą typu IIIB miały wyższe poziomy aktywności w trakcie fazy spoczynku, skróconą fazę spoczynku oraz niższą amplitudę rytmu okołodobowego. Może to tłumaczyć drzemanie podczas fazy aktywności, chodzenie nocne oraz aktywność nocną.
Analiza melatoniny pozyskanej ze śliny wykazała w Mukopolisacharudozie typu III zmieniony rytm okołodobowy stężenia melatoniny z niższymi poziomami melatoniny w nocy i wyższymi poziomami melatoniny wczesnym rankiem. Jednakowoż dane te nie były istotnie różne od kontroli, częściowo ze względu na małą wielkość próbki oraz na dużą różnorodność w obrębie grup. Poziomy melatoniny u typowo rozwijających się dzieci różniły się w odpowiednich punktach czasowych w ciągu dnia i nocy. U pacjentów z MPS III nie wykazano natomiast istotnej różnicy poziomu melatoniny w czasie. W badaniu Canal’a i współpracowników [18], myszy z MPS IIIB wykazywały niższą wrażliwość na światło zarówno na poziomie behawioralnym (krótsza faza zmiany po pulsie światła w ciemności) jak i molekularnym (zmniejszona ekspresja wazoaktywnego peptydu białkowego w jądrze nadskrzyżowaniowym (SCN)). Gdyby porównywalne procesy zachodziły u ludzi z MPS III, mogłoby to stanowić przyczynę odbiegających od normy poziomów melatoniny obserwowanych w bieżącym badaniu.
Biorąc pod uwagę odbiegające od normy stężenia melatoniny obserwowane w Mukopolisacharydozie typu III, egzogenna melatonina zdaje się być najefektywniejszym działaniem farmakologicznym, co zostało potwierdzone przez poprzednie badanie [11]. Najmocniejszym dowodem na skuteczność melatoniny jest redukcja opóźnienia rozpoczęcia snu, ale już mniejszy wpływ wywiera ona na nocne chodzenie [31]. W porównaniu z typową, szybko uwalniającą się formą, melatonina o trwałym uwalnianiu może poprawić utrzymanie snu u dzieci z zaburzeniami neurorozwojowymi [32] ale takie leczenie mogłoby pogłębić senność w ciągu dnia, której powinni unikać pacjenci doświadczający znużenia w ciągu dnia. Ponadto, melatonina powinna być stosowana z ostrożnością i troską w przypadku dzieci, ponieważ długoterminowe skutki jej stosowania nie są znane [33] i istnieją dowody na zwiększenie częstotliwości ataków u dzieci z zaburzeniami neurorozwojowymi cierpiącymi na epilepsję [34].
Jak w przypadku większości badań dotyczących niezwykle rzadkich zaburzeń, obecny rozmiar próby była niewielki, co ograniczało jego statystyczną moc wykrywania różnic pomiędzy grupami oraz różnic pomiędzy podtypami lub stadiami zaburzenia. Badanie odchyleń standardowych ujawniło, że grupa z Mukopolisacharydozą miała większą liczbę stopni swobody we wszystkich pomiarach snu w porównaniu z kontrolą, oraz że trudności związane ze snem, w szczególności opóźnienie momentu rozpoczęcia snu oraz efektywność snu, pogarszały się u dzieci wraz z wiekiem oraz postępowaniem choroby.
Uwzględniając wykonalność aktografii w badanej populacji, jest ona znacznie bardziej odpowiednia niż wpisy do dzienników ponieważ dzieci co do których rodzice zgłaszali problemy tolerowały zegarek, co sugeruje, że jest to odpowiednia metoda do szerszego wykorzystania zarówno w praktyce klinicznej jak i badaniu pacjentów z MPS III.
Dalsze badania są niezbędne do potwierdzenia wyników obecnego badania. Badanie z większą ilością środków, większą próbą, zawierającą zarówno dorosłych jak i dzieci, mogłoby poprzeć powyższe wyniki i dostarczyć dokładniejszych obserwacji na temat snu w różnych stadiach choroby. Niektórzy rodzice dzieci z MPS III zgłosili, że czasami ich dzieci nie śpią w ogóle przez całą noc i ta nieprzewidywalna sytuacja utrudnia znacznie planowanie ich codziennego życia. Prowadzenie nagrań przez dłuższy okres kilku tygodni, mógłby pozwolić na uchwycenie większej różnorodności pomiędzy nocami. Bardziej niż uśrednianie danych z poszczególnych nocy, analizy serii w czasie mogłyby pomóc w identyfikacji wzorców i umożliwić przewidywanie okresów bezsenności a także wydłużone badanie pozwalałoby na obserwowanie pacjentów z MPS III wraz z postępowaniem zaburzenia, co mogłoby dokładniej udokumentować sposób w jaki wzorce senne zmieniają się wraz z wiekiem oraz/lub podtypem choroby.
Obecnie badanych jest wiele obiecujących terapii Mukopolisacharydozy typu III celujących w centralny układ nerwowy, włączając terapię zastępowania enzymu, transplantację hematopoetycznych komórek macierzystych, terapię genową oraz terapię redukcji sybstratu [35]. Do czasu opracowania efektywnej terapii Mukopolisacharydozy typu III, klinicystom pozostaje objawowe leczenie schorzenia, włącznie z zaburzeniami snu, w celu polepszenia jakości życia chorych oraz ich rodzin.
References
- Heron B, Mikaeloff Y, Froissart R, Caridade G, Maire I, et al. (2011) Incidence and natural history of Mucopolysaccharidosis type III in France and comparison with United Kingdom and Greece. Am J Med Genet A 155A: 58–68. doi: 10.1002/ajmg.a.33779
- Meyer A, Kossow K, Gal A, Muehlhausen C, Ullrich K, et al. (2007) Scoring evaluation of the natural course of Mucopolysaccharidosis type IIIA (Sanfilippo syndrome type A). Pediatrics 120: e1255–61. doi: 10.1542/peds.2007-0282
- Cleary MA, Wraith JE (1993) Management of Mucopolysaccharidosis type-III. Arch Dis Child 69: 403–406. doi: 10.1136/adc.69.3.403
- Van De Kamp JJP, Niermeijer MF, Von Figura K, Giesberts MAH (1981) Genetic heterogeneity and clinical variability in the Sanfilippo syndrome types A B and C. Clin Genet. 20: 152–160. doi: 10.1111/j.1399-0004.1981.tb01821.x
- Ruijter GJG, Valstar MJ, de Kamp JM, van der Helm RM, Durand S, et al. (2008) Clinical and genetic spectrum of Sanfilippo type c (MPS IIIC) disease in the Netherlands. Mol Genet Metab 93: 104–111. doi: 10.1016/j.ymgme.2007.09.011
- Valstar MJ, Ruijter GJG, van Diggelen OP, Poorthuis BJ, Wijburg FA (2008) Sanfilippo syndrome: A mini-review. J Inherit Metab Dis 31: 240–252. doi: 10.1007/s10545-008-0838-5
- Bax MCO, Colville GA (1995) Behaviour in Mucopolysaccharide disorders. Arch Dis Child 73: 77–81. doi: 10.1136/adc.73.1.77
- Colville GA, Watters JP, Yule W, Bax M (1996) Sleep problems in children with Sanfilippo syndrome. Dev Med Child Neurol 38: 538–544. doi: 10.1111/j.1469-8749.1996.tb12114.x
- Cross E (2012) An investigation into the middle and late behavioural phenotypes of Mucopolysaccharidosis type-III (Unpublished doctoral dissertation). University of Manchester, Manchester, UK.
- Fraser J, Gason AA, Wraith JE, Delatycki MB (2005) Sleep disturbance in Sanfilippo syndrome: A parental questionnaire study. Arch Dis Child 90: 1239–1242. doi: 10.1136/adc.2004.065482
- Fraser J, Wraith JE, Delatycki MB (2002) Sleep disturbance in Mucopolysaccharidosis type III (Sanfilippo syndrome): a survey of managing clinicians. Clin Genet 62: 418–421. doi: 10.1034/j.1399-0004.2002.620512.x
- Mariotti P, Della Marca G, Iuvone L, Vernacotola S, Ricci R, et al. (2003) Sleep disorders in Sanfilippo syndrome: A polygraphic study. Clin Electroencephalogr 34: 18–22.
- Tikotzky L, Sadeh A (2001) Sleep patterns and sleep disruptions in kindergarten children. J Clin Child Psychol 30: 581–591. doi: 10.1207/s15374424jccp3004_13
- Jean-Louis G, Kripke DF, Mason WJ, Elliott JA, Youngstedt SD (2001) Sleep estimation from wrist movement quantified by different actigraphic modalities. J Neurosci Methods 105: 185–191. doi: 10.1016/s0165-0270(00)00364-2
- De Leersnyder H, Claustrat B, Munnich A, Verloes A (2006) Circadian rhythm disorder in a rare disease: Smith-Magenis syndrome. Mol Cell Endocrinol 252: 88–91. doi: 10.1016/j.mce.2006.03.043
- De Leersnyder H, De Blois MC, Claustrat B, Romana S, Albrecht U, et al. (2001) Inversion of the circadian rhythm of melatonin in the Smith-Magenis syndrome. J Pediatr 139: 111–116. doi: 10.1067/mpd.2001.115018
- Guerrero JM, Pozo D, Diaz-Rodriguez JL, Martinez-Cruz F, Vela-Campos F (2006) Impairment of the melatonin rhythm in children with Sanfilippo syndrome. J Pineal Res 40: 192–193. doi: 10.1111/j.1600-079x.2005.00294.x
- Canal MM, Wilkinson FL, Cooper JD, Wraith JE, Wynn R, et al. (2010) Circadian rhythm and suprachiasmatic nucleus alterations in the mouse model of Mucopolysaccharidosis IIIB. Behav Brain Res 209: 212–220. doi: 10.1016/j.bbr.2010.01.045
- Langford-Smith K, Arasaradnam M, Wraith JE, Wynn R, Bigger BW (2010) Evaluation of heparin cofactor II-thrombin complex as a biomarker on blood spots from Mucopolysaccharidosis I, IIIA and IIIB mice. Mol Genet Metab 99: 269–274. doi: 10.1016/j.ymgme.2009.10.175
- Langford-Smith KJ, Mercer J, Petty J, Tylee K, Church H, et al. (2011) Heparin cofactor II-thrombin complex and dermatan sulphate:chondroitin sulphate ratio are biomarkers of short- and long-term treatment effects in Mucopolysaccharide diseases. J Inherit Metab Dis 34: 499–508. doi: 10.1007/s10545-010-9254-8
- Samel A, Wegmann HM, Vejvoda M, Maass H, Gundel A, et al. (1991) Influence of melatonin treatment on human circadian rhythmicity before and after a simulated 9-hr time shift. J Biol Rhythms 6: 235–248. doi: 10.1177/074873049100600304
- Owens JA, Spirito A, McGuinn M (2000) The Children’s Sleep Habits Questionnaire (CSHQ): Psychometric properties of a survey instrument for school-aged children. Sleep 23: 1043–1051.
- Acebo C, Sadeh A, Seifer R, Tzischinsky O, Wolfson AR, et al. (1999) Estimating sleep patterns with activity monitoring in children and adolescents: How many nights are necessary for reliable measures? Sleep 22: 95–103.
- Galland BC, Taylor BJ, Elder DE, Herbison P (2012) Normal sleep patterns in infants and children: A systematic review of observational studies. Sleep Med Rev 16: 213–222. doi: 10.1016/j.smrv.2011.06.001
- Paavonen EJ, Fjallberg M, Steenari MR, Aronen ET (2002) Actigraph placement and sleep estimation in children. Sleep 25: 235–237.
- Stores G, Montgomery P, Wiggs L (2006) The psychosocial problems of children with narcolepsy and those with excessive daytime sleepiness of uncertain origin. Pediatrics 118: E1116–E1123. doi: 10.1542/peds.2006-0647
- El-Sheikh M, Buckhalt JA, Keller PS, Granger DA (2008) Children’s objective and subjective sleep disruptions: Links with afternoon cortisol levels. Health Psychol 27: 26–33. doi: 10.1037/0278-6133.27.1.26
- Scholle S, Beyer U, Bernhard M, Eichholz S, Erler T, et al. (2011) Normative values of polysomnographic parameters in childhood and adolescence: Quantitative sleep parameters. Sleep Med 12: 542–549. doi: 10.1016/j.sleep.2010.11.011
- Lin HY, Chen MR, Lin CC, Chen CP, Lin DS, et al. (2010) Polysomnographic characteristics in patients with Mucopolysaccharidoses. Pediatr Pulmonol 45: 1205–1212. doi: 10.1002/ppul.21309
- Santamaria F, Andreucci MV, Parenti G, Polverino M, Viggiano D, et al. (2007) Upper airway obstructive disease in Mucopolysaccharidoses: Polysomnography, computed tomography and nasal endoscopy findings. J Inherit Metab Dis 30: 743–749. doi: 10.1007/s10545-007-0555-5
- Phillips L, Appleton RE (2004) Systematic review of melatonin treatment in children with neurodevelopmental disabilities and sleep impairment. Dev Med Child Neurol 46: 771–775. doi: 10.1111/j.1469-8749.2004.tb00998.x
- Jan JE, Hamilton D, Seward N, Fast DK, Freeman RD, et al. (2000) Clinical trials of controlled-release melatonin in children with sleep-wake cycle disorders. J Pineal Res 29: 34–39. doi: 10.1034/j.1600-079x.2000.290105.x
- Stores G (2003) Medication for sleep-wake disorders. Arch Dis Child 88: 899–903. doi: 10.1136/adc.88.10.899
- Sheldon SH (1998) Pro-convulsant effects of oral melatonin in neurologically disabled children. Lancet 351: 1254–1254. doi: 10.1016/s0140-6736(05)79321-1
- de Ruijter J, Valstar MJ, Wijburg FA (2011) Mucopolysaccharidosis type III (sanfilippo syndrome): Emerging treatment strategies. Curr Pharm Biotechnol 12: 923–930. doi: 10.2174/138920111795542651

